이승재 건국대 교수팀 '뇌염증' 발생기전 규명
퇴행성 뇌질환 치료법 개발 새로운 가능성 제시
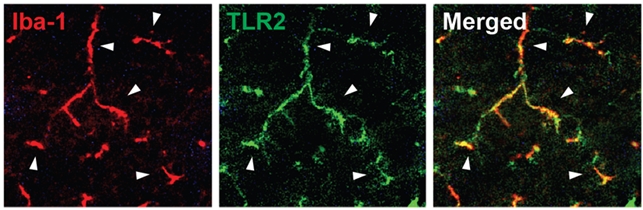
최근 급속한 고령화로 퇴행성 뇌질환이 심각한 사회문제로 대두되고 있지만 그 발병이나 진행기전에 대한 구체적인 이해가 부족해 근본적 치료법이 없는 상황이다. 뇌염증 반응이나 단백질의 응집과 같은 병리현상이 신경세포 사멸과 연결될 것이라는 이론적 배경에 따라 관련연구가 진행되고 있으나 그 병리현상의 발전기전은 거의 알려지지 않고 있다. 교육과학기술부와 한국연구재단은 이승재 건국대 교수팀이 신경세포로부터 분비된 '알파-시뉴클린'이 뇌조직의 면역세포 표면에 존재하는 톨유사수용체2의 신호전달체계를 활성화시켜 주변 신경세포로의 손상이 확장돼 염증반응이 일어난다는 사실을 규명했다고 11일 밝혔다.
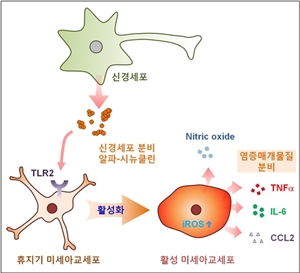 |
| ▲파킨슨병에서의 뇌염증반응 유도기전 모델 이미지. ⓒ2013 HelloDD.com |
나아가 연구팀은 마치 자물쇠와 열쇠처럼 톨유사수용체2에 알파-시뉴클린이 직접 결합함을 확인했다. 특히 단량체나 피브릴 형태가 아닌 베타-쉬트 구조의 알파-시뉴클린 중합체만이 수용체에 결합해 활성화시킴을 규명했다. 이 교수는 "이번 연구는 퇴행성 뇌질환에서 염증반응이 유도되는 새로운 기전을 제시하고, 이에 근거해 질병의 진행을 차단할 수 있는 가능성을 제시한데 큰 의의가 있다"며 "이번 연구결과는 기초연구 수준에서의 기전 제시이므로 치료법 개발을 위해서는 아직 기전의 확실한 검증 및 응용과정을 거쳐야한다"고 말했다. 연구성과는 네이처 커뮤니케이션스(Nature Communications)지 6일자에 게재됐다. 연구에는 김창연 건국대 박사, 이혜진 건국대 교수, 포스텍 황대희 교수, 엘리에저 마슬리아 캘리포니아대 교수, 이성중 서울대 교수 등이 참여했다.
 |
| ▲(왼쪽부터) 이승재 교수와 제 1저자 김창연 박사. ⓒ2013 HelloDD.com |
| 알파-시뉴클린(a-synuclein) 신경세포에서 발현되는 단백질로서 이 단백질의 응집 및 축적이 파킨슨병, 루이소체치매 등 뇌질환 발병에 중요한 요소이다. 톨유사수용체(Toll-like receptor, TLR2) 병원체를 인식하여 포식세포가 병원체를 제거하고 염증반응을 일으키도록 하는 수용체이다. 피브릴(fibril) 퇴행성 뇌질환조직에서 발견되는 필라멘트 형태의 단백질 응집체 베타-쉬트(beta-sheet) 단백질 이차구조 중 하나. 퇴행성 뇌질환이 발생하는 과정에서 특정 단백질들이 베타-쉬트를 많이 갖는 형태로 구조변환을 한다. 이러한 단백질의 구조변환은 대부분의 퇴행성뇌질환에서 공통적으로 나타나는 현상으로서 뇌염증반응과 함께 질병의 중요한 기전을 이룬다고 여겨진다. |
댓글 정렬