김규원 교수 "치사율 높이는 항암제 개발 방법 제시"
김규원 서울대 교수 연구팀이 암세포가 항암제나 방사선 치료 등의 스트레스 상황에서 살아남을 수 있도록 돕는 특정 단백질의 세포 방어 역할 방법을 규명했다고 19일 밝혔다.
인체는 외부 환경의 스트레스로부터 스스로를 보호할 수 있는 방어 능력을 가지고 있다. 세포가 갑작스러운 고열이나, 저산소, 독성 물질 등과 같은 공격적인 외부 환경에 노출되면 스스로를 방어하기 위해 '열 충격 반응 (Heat Shock Response)'이라는 방어 기전을 작동한다.
특히 암세포는 스트레스 상황에서 생존하기 위한 자가 방어 메커니즘이 잘 갖추어져 있다. 그 중 하나는 암세포 열 충격 단백질(Hsp70)의 발현이다. 암세포가 스트레스를 받으면 세포 내 단백질 구조에 손상을 입게 된다. 이때 발현된 Hsp70은 손상된 단백질을 처리해 세포를 보호한다.
Hsp70은 손상된 단백질의 구조를 본래 상태로 복구시키거나, 분해하여 세포 내에서 완전히 제거해버린다. 그러나 이 단백질이 어떻게 '복구'와 '제거'를 구별하며, 두 과정이 어떻게 선택적으로 조절되는지에 대해서는 알려진 바가 없었다.
연구팀은 암세포가 스트레스를 받으면 Hsp70의 77번째 아미노산(K77)이 효소(ARD1)에 의해 단백질 변형의 일종인 '아세틸화'되는 것을 관찰하고, Hsp70의 아세틸화가 손상된 단백질의 복구와 제거를 결정하는 스위치 역할을 한다는 사실을 밝혀냈다.
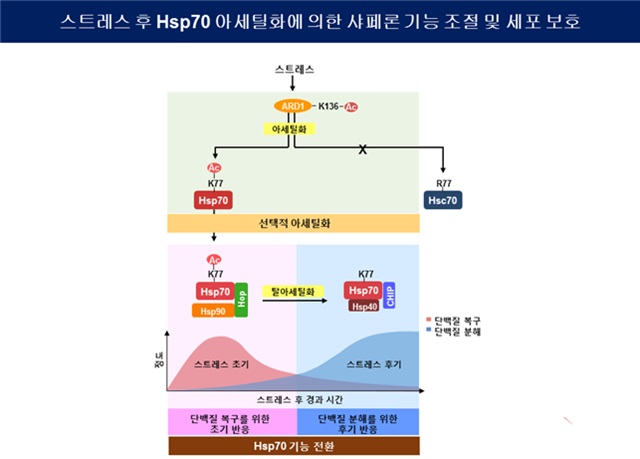
스트레스 초기에 아세틸화된 Hsp70은 손상된 단백질을 복구하는 역할을 한다. 그러나 후기에 탈아세틸화된 Hsp70은 복구되지 못한 채 남아있는 손상 단백질을 제거하는 역할을 한다. 즉, Hsp70의 아세틸화·탈아세틸화의 순차적 과정이 손상 단백질을 복구할지 제거할지를 결정하고 진행하는 것이다.
연구팀에 따르면 세포에서 Hsp70의 아세틸화를 차단하면, 암세포 내 손상된 단백질을 처리하는 과정에 문제가 생겨 항암치료에 대한 암세포의 치사율이 높아짐에 따라 효과적인 항암치료가 가능해진다.
김규원 교수는 "이번 연구성과는 향후 Hsp70 아세틸화를 타겟으로 한 항암제 개발과 더불어 뇌졸중, 알츠하이머, 파킨슨씨병 등의 신경 질환을 예방하는 방법에도 응용될 수 있을 것이다"고 말했다.
이번 연구 성과는 국제학술지 '네이처 커뮤니케이션즈(Nature Communications)'에 지난 6일자로 게재됐다.
댓글 정렬